Производств субстанций
1 Цель
Историческое прошлое
Когда PIC / S выступил с инициативой на совещании в Канберре в сентябре 1996 года по разработке согласованного на глобальном уровне руководства по надлежащей производственной практике (GMP) для производства активных фармацевтических ингредиентов (АФИ), была высказана рекомендация, что это должно быть "что делать», а не «как делать» документ.
После этой инициативы международная конференция по гармонизации (ICH), которая состоит из трех основных фармацевтических регионов мира - США, Японии и Европы - взяла эту тему на вооружение. ICH учредил Рабочую группу экспертов, членство в которой было обусловлено важностью темы, выходящей за пределы трех регионов, для ВОЗ, членов PIC / S, Индии, Китая, и CEFIC / APIC. В течение 2,5 лет EWG составила руководство «GMP для API». Документ был доработан к ноябрю 2000 года и в настоящее время внедряется в трех регионах.
Цель документа ICH Q7a
Промышленность должна избегать ненужной бумажной работы и административного бремени. Как указано в документе Q7a, основное внимание следует уделять - в интересах пациента - выявлению критических элементов управления и процедур, обеспечивающих качество API. Следовательно, при создании системы качества, включающей GMP, должно быть обоснованное научное суждение. Слово «должен» широко используется в окончательной версии Руководства ICH Q7a. В нем указаны требования и рекомендации, которые, как ожидается, будут применяться, если только не будет показано, что они не применимы или не заменены альтернативой, которая, как можно показать, обеспечивает по крайней мере эквивалентный уровень обеспечения качества.
Нормативные требования
Компании должны знать, что нормативные требования к подаче заявок могут отличаться от применения GMP, как определено в Q7a. Могут быть случаи, когда регулирующим органам может потребоваться больше информации, но проверки на соответствие Руководству Q7a должны охватывать только аспекты связанные с GMP.
Исходные материалы для производства субстанций
| Определение исходного материала API (ICH Q7A 1.3, см. Главу E.6 ICH Q7A: Надлежащая производственная практика для активных фармацевтических ингредиентов) |
|---|
«Исходный материал API» - это исходный материал, промежуточный продукт или API, который используется при производстве API и который включен как существенный структурный фрагмент в структуру API. Исходным материалом API может быть товар, материал, приобретенный у одного или нескольких поставщиков по контракту или коммерческому соглашению, или произведенный собственными силами. Исходные материалы API обычно имеют определенные химические свойства и структуру. |
Компании несут ответственность за предложение исходных материалов API. Это одно из наиболее важных предложений в документе ICH Q7a. Отдел качества должн тесно сотрудничать с регулирующими органами, чтобы не допустить разногласий в отношении предлагаемых исходных материалов. В идеале регистрация новых API будет начинаться с тех же исходных материалов, которые определены с точки зрения GMP. Однако, исходя из текущих нормативных требований, вероятно, что регулирующим органам потребуется дополнительная информация о исходных материалах API, если между исходным материалом API и API существует только один или два синтетических этапа или если исходный материал API является самим API.
Компании должны проанализировать процесс синтеза каждого API и на основе технических и качественных оценок определить, какие существенные структурные фрагменты должны выходить за рамки стандартов GMP, определенных в ICH Q7a. В целом, исходные материалы API не являются основным фактором.
Заявления о сертификации EP требуют, чтобы было сделано заявление о том, что продукт изготовлен в соответствии с GMP. Эта декларация не распространяется на «Исходный материал API», описанный в Фармакопее. Очевидно, что это может противоречить определению Q7a в Исходных материалах API.
Регулирующим органам также могут потребоваться дополнительные сведения для исходных материалов API поздней стадии, хотя известны недавние примеры того, что были приняты конечные промежуточные продукты в качестве материалов, излагающих API (например, широко коммерчески доступное вещество или 6-APA для производства полусинтетических пенициллинов).
Руководство по определению исходных материалов API
- Следуйте указаниям, данным в ICH Q7A, и привлеките технические, качественные и регулирующие отделы к согласованию определения исходных материалов API. Там, где это возможно, используйте такое же определение исходного материала API в нормативных документах и при определении этапов, к которым применяются требования GMP ICH Q7a.
- Дальнейшие указания о том, как определить исходные материалы API и стратегию регулирования, приведены в
- «Исходные материалы для активных фармацевтических ингредиентов (APISM) и другие материалы в производстве API: научно обоснованные принципы для общего технического досье» Хельги Меллер и Криса Олденхофа, Drug Information Journal, том 33, номер 3, 1999, страницы 755 - 761 а также
- Eudralex Vol. 2b, стр. 162 («Валидация процесса должна проводиться ... для этапов производственного процесса, которые имеют решающее значение для продукта»)
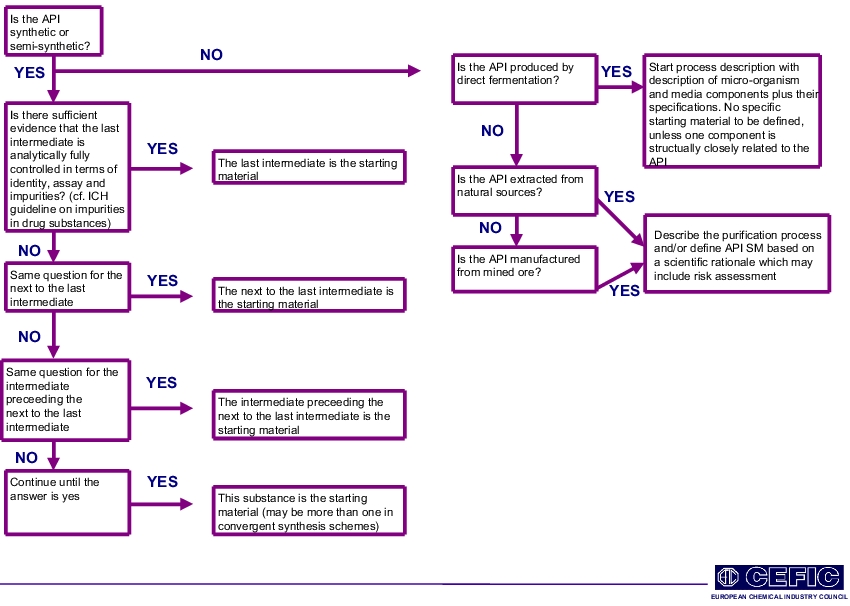
- Дерево решений по исходным материалам API, разработанное CEFIC / APIC и FIP, является центральной особенностью этого руководства (см. Рисунок 3).
- В тех случаях, когда предлагаемый исходный материал API близок к самому API, убедитесь, что имеются подробные сведения о синтетическом процессе и аналитических средствах контроля, используемых для производства исходного материала API, в случае, если они все еще (обоснованно) будут запрашиваться регулирующими органами. В тех случаях, когда исходный материал API является коммерческой молекулой, требование о предоставлении этих подробностей (если это необходимо по соображениям конфиденциальности: только властям) может быть включено в коммерческий контракт.
- Аналогичным образом, требования к контролю изменений должны быть определены в коммерческом контракте на поставку исходных материалов API. Любые существенные изменения в синтетическом маршруте, аналитических средствах управления или спецификациях изготовителя исходных материалов API, как правило, требуют уведомления и принятия производителем API.
- Хотя исходные материалы API не требуют производства в соответствии с требованиями GMP, определенными в ICH Q7a, производители промежуточных продуктов и / или API должны иметь систему оценки поставщиков критически важных материалов (Ссылка Q7a, раздел 7.11 - глава E.6 ICH Q7A: Надлежащая производственная практика для активных фармацевтических ингредиентов). Требуется соответствующая квалификация поставщиков исходных материалов API.
- Компании должны рассмотреть возможность переопределения исходного материала API для устоявшихся продуктов. Это дает возможность снизить общие требования GMP для ранних этапов производства и сместить акцент на контроль критических этапов синтеза, начиная с переопределенных исходных материалов API. Любые предлагаемые переопределения исходных материалов API должны, конечно, согласовываться с регулирующими органами. FDA уже заявили о своей готовности снизить требования к подаче заявок для некоторых хорошо известных «квалифицированных продуктов», включая те, которые относятся к последним этапам синтеза API.
| Type of |
Application of this Guide to steps (shown in grey) used in this type of manufacturing |
||||
|---|---|---|---|---|---|
Chemical Manufacturing |
Production of the API Starting Material |
Introduction of the API Starting Material into process |
Production of Intermediate(s) |
Isolation and purification |
Physical processing, and packaging |
API derived from animal sources |
Collection of organ, fluid, or tissue |
Cutting, mixing, and/or initial processing |
Introduction of the API Starting Material into process |
Isolation and purification |
Physical processing, and packaging |
API extracted from plant sources |
Collection of plant |
Cutting and initial extraction(s) |
Introduction of the API Starting Material into process |
Isolation and purification |
Physical processing, and packaging |
Herbal extracts used as API |
Collection of plants |
Cutting and initial extraction |
- |
Further extraction |
Physical processing, and packaging |
API consisting of comminuted or powdered herbs |
Collection of plants and/or cultivation and harvesting |
Cutting/comminuting |
- |
- |
Physical processing, and packaging |
Biotechnology: Fermentation/cell culture |
Establishment of master cell bank and working cell bank |
Maintenance of working cell bank |
Cell culture and/or fermentation |
Isolation and purification |
Physical processing, and packaging |
„Classical" Fermentation to produce an API |
Establishment of cell bank |
Maintenance of the cell bank |
Introduction of the cells into fermentation |
Isolation and purification |
Physical processing, and packaging |
|
|||||
|
| Помещения | |
| Оборудование | |
| Документация и записи | |
| Работа с материалами | |
| Технологический процесс | |
| Упаковке и идентификация API, и промежуточных продуктов | |
| Хранение и распределение | |
| Контроль качества |
| Фармацевтическая система качества | |
| Персонал | |
| Помещения | |
| Оборудование | |
| Сервисные системы | |
| Документация | |
| Технологический процесс | |
| Валидация | |
| Контроль качества | |
| Аутсорсинговая деятельность | |
| Cамоинспекция |